Amiloidosis hereditaria por transtiretina TTR
¿Qué es la amiloidosis hereditaria por transtiretina?
La amiloidosis por transtiretina hereditaria (también llamada familiar) es una enfermedad poco común debido a una anomalía (mutación) de parte de su ADN (gen). Este gen produce una proteína, transtiretina o TTR. La amiloidosis TTR afecta principalmente a los nervios (neuropatía), al corazón, pero también, más raramente, a los ojos y los riñones.
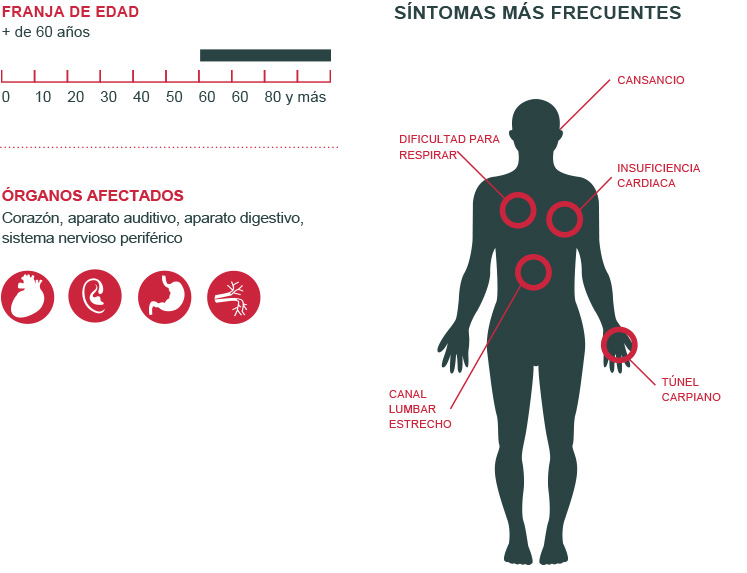
Esta enfermedad afecta a adultos (de 20 a 88 años). La edad de inicio de la enfermedad es muy variable.
Esta es una enfermedad debilitante potencialmente muy grave si el sujeto no recibe tratamiento y atención especializada.
¿Cuáles son las causas de la enfermedad?
La presencia de una mutación en el gen codificador de la síntesis de transtiretina es casi siempre responsable. Casi toda la transtiretina es sintetizada por el hígado.
La proteína TTR en su estado normal suele servir para transportar sustancias en la sangre: la hormona tiroidea (tiroxina) y la proteína de unión del retinol. Circula en forma de una molécula llamada tetrámero con cuatro componentes idénticos. Cuando el gen muta, la proteína producida sufre una modificación. Sus cuatro componentes se dislocan y depositan en forma de sustancia amiloide tóxica en los tejidos y órganos, alterando así sus funciones.
¿Cuáles son las manifestaciones de la enfermedad?
Manifestaciones relacionadas con una neuropatía (afección del sistema nervioso periférico)
Estas manifestaciones reveladoras son muy variadas, lo que explica en gran parte por qué se retrasa el diagnóstico. Indican un mal funcionamiento de los nervios periféricos sensoriales, motores y vegetativos.
Esto puede ser:
Una pérdida de sensibilidad en los pies, predominantemente en la sensibilidad a la temperatura y al dolor; dolor espontáneo e intenso (como “ardor”) o sensaciones desagradables (parestesia) herida o dolor no percibido o que no cicatriza.
Debilidad en los pies o, más raramente, en las manos que dificultan la marcha o los gestos precisos. Dificultades para caminar o pérdida del equilibrio en pacientes mayores.
Los trastornos vegetativos también pueden ocurrir por lesiones en los nervios que controlan los sistemas digestivo, genital, cardiovascular y urinario con respectivamente: náuseas, digestión lenta, pérdida de apetito o, más raramente, vómitos, estreñimiento, diarrea o alternancia entre diarrea y estreñimiento, trastornos de la erección, mareos, desmayos al levantarse, dificultad para orinar.
A medida que la enfermedad evoluciona, los trastornos de sensibilidad se extienden gradualmente a las rodillas y luego a las manos: la debilidad en las extremidades se acentúa y los trastornos vegetativos empeoran.
Pérdida de peso: también es habitual una pérdida de peso involuntaria de más de 5 kg durante seis meses; puede ser inaugural.
Manifestaciones relacionadas con enfermedades cardíacas.
Una afección cardíaca es muy frecuente, sobre todo cuando la enfermedad comienza tarde y según el tipo de mutación que sufra el gen responsable de la enfermedad. Estas manifestaciones son silenciosas durante muchos años, de ahí la importancia de las revisiones cardíacas periódicas.
Estos pueden ser:
Trastornos de la conducción: riesgo de ralentización extrema de los latidos del corazón o incluso paro cardíaco que puede requerir la implantación de un marcapasos. Esto resulta necesario en casi un tercio de los casos durante la evolución de la enfermedad.
Infiltración cardíaca por los depósitos de amiloidosis que conduce a aumento del grosor y rigidez del corazón, disnea en caso de esfuerzo (insuficiencia cardíaca).
Un ataque a los nervios del sistema cardiovascular (presión arterial baja, solo después de levantarse, pérdida de las variaciones normales del latido del corazón, anomalías en la gammagrafía MIBG.
Cuando el corazón comienza a verse afectado por la amiloidosis, el paciente no siempre es consciente del problema, por lo que la detección de la afección cardíaca es indispensable y requiere un control inicial minucioso. La detección precoz es sumamente importante porque condiciona un tratamiento rápido tan pronto como se han detectado las anomalías.
Manifestaciones relativas a los ojos.
Existen varios tipos de afecciones oculares que dependen de dónde se encuentran los depósitos de amiloide en el ojo y varían considerablemente de un paciente a otro.
Los depósitos en el cuerpo vítreo ocurren en 20 a 30% de los casos durante la enfermedad. Se manifiestan con mayor frecuencia por la percepción de «cuerpos flotantes» o «moscas voladoras». Si los depósitos son densos, pueden causar problemas de visión.
El glaucoma es secundario a depósitos de amiloide en el mecanismo de evacuación del humor acuoso. Este obstáculo para la reabsorción del humor acuoso se acompaña de un aumento gradual de la presión dentro del ojo que el paciente no puede sentir. Sin embargo, provoca daños irreversibles en el nervio óptico provocando trastornos del campo visual.
Sin un tratamiento adaptado, el glaucoma conduce a la pérdida permanente de la vista. El glaucoma ocupa alrededor del 20% de los pacientes afectados de amiloidosis.
La sequedad del ojo es muy frecuente en el caso de pacientes con amiloidosis. Esto se manifiesta por una sensación de escozor o sensación de cuerpo extraño. Esto se debe a un mal funcionamiento de las glándulas lagrimales infiltradas por amiloidosis.
Por todo ello, es indispensable que el paciente se someta a un examen ocular sistemático seguido de controles periódicos de las alteraciones vítreas (agudeza visual y fondo de ojo), glaucoma (tensión ocular y si existe la menor duda del campo visual y un análisis de las fibras en el nervio óptico por OCT) y sequedad del ojo.
Manifestaciones menos frecuentes.
Afección de los riñones (proteinuria, insuficiencia renal) o en casos excepcionales daño de las meninges con cefalea y confusión.
¿Cómo se diagnostica una neuropatía amiloide?
El diagnóstico de neuropatía amiloide puede ser difícil y a menudo se retrasa, teniendo en cuenta que los trastornos son irreversibles. Es importante que los pacientes con neuropatia amiloide se les aplique un estudio de antecedentes familia
El retraso en el diagnóstico puede variar de 3 a 6 años, ya que inicialmente se sospecha que una causa de neuropatía distinta de la amiloidosis es la causa de los problemas de salud del paciente.
El diagnóstico se basa actualmente en tres elementos:
Información recopilada durante las consultas médicas con un neurólogo capacitado para esta rara enfermedad. Toda esta información se puede recopilar gracias al interrogatorio para detectar manifestaciones neurológicas, mediante un examen clínico neurológico para buscar ciertos signos particularmente distintivos o mediante datos de un electromiograma.
Otros elementos traerán argumentos en el campo cardiológico gracias a un electrocardiograma y una ecografía cardíaca.
Una prueba genética, tras un simple análisis de sangre, indispensable para afirmar la presencia de una mutación del gen de la transtiretina responsable de la amiloidosis y una biopsia para demostrar la presencia de depósitos anormales de sustancias amiloides.
¿A partir de qué momento se detecta que un paciente porta un gen de transtiretina mutado realmente se considera enfermo?
Este tema es de gran importancia por varias razones.
De hecho, los trastornos causados por la enfermedad suelen ser irreversibles y cuanto más temprano se administran los tratamientos existentes, más efectivos son. Sin embargo, la enfermedad se afianza de forma insidiosa, lo que dificulta ponerle una fecha precisa y sabemos que la mayoría de los portadores del gen de la transtiretina mutado desarrollarán la enfermedad algún día.
Para identificar este momento, es necesario en consecuencia un esfuerzo concertado por parte de los pacientes portadores de la mutación, médicos especializados capacitados para esta enfermedad y ciertas exploraciones complementarias si es necesario para confirmar la presencia de amiloidosis, de ahí la importancia de que los portadores de mutaciones tomen balance de la situación periódicamente mediante un control anual.
Si todas las condiciones juntas llevan a afirmar que la enfermedad ha comenzado, entonces el médico especializado inicia un tratamiento existente.
A la existencia de una sospecha es importante realizar el diagnostico temprano, pues incluso llegan a una etapa muy avanzada de la enfermedad, mientras que se les diagnosticó positivo durante las pruebas genéticas realizadas varios años antes.
Transmisión familiar y asesoramiento genético.
El cribado en familias con neuropatía amiloide es fundamental para la detección y seguimiento de los portadores de mutaciones genéticas que puedan desarrollar la enfermedad más adelante en la vida.
La anomalía genética responsable de la amiloidosis se transmite en la familia de padres a hijos. Cada niño tiene un riesgo de uno en dos de recibir el gen anormal del padre afectado (transmisión autosómica dominante) y, por lo tanto, de desarrollar la enfermedad más adelante en la vida. La enfermedad se desarrollará en una gran mayoría de personas con la anomalía genética a medida que el riesgo aumenta con la edad.
Tratamientos anti-amiloides
Su propósito es prevenir la formación de nuevos depósitos de amiloidosis estabilizando la transtiretina y bloqueando su producción. Los tratamientos disponibles hasta ahora solo pueden ralentizar la progresión e incluso detenerla, pero no deshacerse de los síntomas ya presentes.
Trasplante de hígado
El propósito de un trasplante de hígado es eliminar el órgano principal que produce la proteína TTR anormal, incluso si el hígado funciona perfectamente bien. Un trasplante de hígado es una operación complicada que debe realizarse en un centro especializado.
Este tratamiento se ha ofrecido a más de 2000 pacientes en todo el mundo. Ha sido eficaz para detener la progresión de la enfermedad en una gran mayoría de casos (70%) tratados en sus primeras etapas. No se recomienda para pacientes que desarrollaron la enfermedad a una edad avanzada o para portadores de cierto tipo de mutación. No se puede realizar en pacientes mayores de 70 años.
A pesar del trasplante, la enfermedad a veces continúa desarrollándose en el sistema nervioso y el corazón. Este deterioro puede explicarse por una acumulación de TTR no mutado (salvaje) después de un trasplante de hígado en sujetos mayores de 50 años.




